
 L-форма
аминокислот. Генетический код и правила отбора для кодон-аминокислотного
соответствия,ПОСТУЛАТ по адресам: http://gencodigra.narod.ru и http://ak-codon.narod.ru . Спектры встречаемости аминокислот в белках.
L-форма
аминокислот. Генетический код и правила отбора для кодон-аминокислотного
соответствия,ПОСТУЛАТ по адресам: http://gencodigra.narod.ru и http://ak-codon.narod.ru . Спектры встречаемости аминокислот в белках.
![]() Кандидат
ф.-м. наук Керимбеков Азад Велиевич, г.
Ставрополь.
Кандидат
ф.-м. наук Керимбеков Азад Велиевич, г.
Ставрополь.
 Оглавление: Контакты:
Оглавление: Контакты:
Нарушение энантиомерного равновесия.
style='color:blue'>
Проблема происхождения
генетического кода. gypoteza@yandex.ru
Кодон-аминокислотное соответствие.
Спектры встречаемости АК в белках. Последнее обновление 14 октября 2007 г.
![]()
Нарушение энантиомерного равновесия на
начальном этапе молекулярной эволюции.
L – Серин.
Обосновывается выбор стартовой органической молекулы – аминокислоты Серин. На основании квантово-механических
расчетов показано образование квазицикла в молекуле серина. Выдвигается и
обосновывается гипотеза о хиральном факторе молнии, приводящим к нарушению
энантиомерного равновесия – гибели D – изомера и
стабилизации L – изомера серина. Рассмотрен возможный
механизм закрепления эффекта хирализации Опаринских коацерватов. Постулируется
присущее только Вселенной из вещества существование L – аминокислотных белков.
Введение.
В
настоящее время можно считать сложившимся и общепринятым мнение о начале
абиогенеза с простейших аминокислот (АК), азотистых оснований и простейших
сахаров.
Однако, пока не существует сколь-нибудь
удовлетворительного объяснения причин происхождения хиральных биомолекул –
белков ( в составе L – аминокислоты ) и нуклеиновых кислот
( в составе D – сахара ).На
основании данных о строении белков
логично предположить, что молекулярная эволюция «стартовала» с некоторой
ключевой АК, именно с ее оптического L- изомера. В связи с этим целесообразно проанализировать
возможность выбора молекулы, которая удовлетворяла бы основным условиям
(сформулированы ниже ) и определить хирализующий фактор, который привел к необратимому нарушению энантиомерного
равновесия. Гипотеза о квазицикле
серина и его роли в нарушении энантиомерного равновесия впервые изложена А.В.Керимбековым. Этот сайт – обобщение и исправление предыдущих электронных
публикаций.
В Internet есть
сообщение о роли СЕРИНА, как ключевой молекулы на начальном этапе эволюции:
http://www.compulenta.ru/2003/8/7/41224/ «Группа Грэма Кукса из Университета
Пердью (Уэст-Лафайетт, штат Индиана) выяснила, почему первые "строительные
блоки" биологических молекул имели левостороннюю ориентацию». «Как
выяснилось, молекулы "левого" серина способны легко формироваться в
цепочки, в которых каждое звено прочно связано друг с другом. Левосторонние
сериновые кластеры, в свою очередь, "сами собой" соединяются с
другими левосторонними аминокислотами. Правосторонний серин, по мнению ученых,
не обладает способностями формировать прочные связи и поэтому не обладает столь
выраженными "конструкторскими способностями"».
Судя по краткому сообщению на Compulenta.ru авторы экспериментировали с
поляризованным светом, однако конкретный механизм нарушения зеркальной симметрии
остался не выясненным. Журналистская версия … И, тем не менее, обоснование
выбора конкретной ключевой молекулы заслуживает особого внимания.
Обоснование
выбора ключевой молекулы.
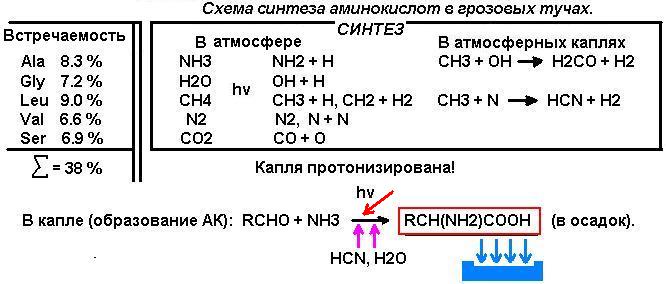
1.
Молекула должна быть простейшей АК.
Естественно руководствоваться логикой
синтеза органических соединений из молекул газов первичной атмосферы. По данным работы М.Е.Акопяна (1)
фотохимические процессы с участием возбужденных атомов, молекул, радикалов
протекали, вероятнее всего, последовательно в газовой фазе. Решающие процессы завершались в каплях атмосферной влаги, преимущественно
на их поверхности. В качестве конечных продуктов образовывались, в частности,
простейшие алифатические АК и
аминокислоты с простыми алифатическими радикалами, и такими, как например,
-СН2-ОН. Это глицин (Gly), аланин (Ala), лейцин (Leu),
валин (Val) и серин (Ser).
2. Простейшие
АК должны служить надежным исходным материалом в последующем синтезе более
сложных протеиногенных аминокислот. В отношении многообразия
возможностей из ряда Gly, Ala, Leu, Val, Ser выделяется,
имеющая ОН-группу, молекула СЕРИНА. В
условиях, когда реакции происходят между возбужденными частицами, гидроксильная
группа серина может быть легко замещена, например алкильными радикалами. При
этом образуются аланин, лейцин и другие АК (2). Известен и путь превращения
серина в глицин, который может так же легко алкилироваться. В итоге серии
подобных реакций в среде образуется избыток
простейших АК и некоторый понятный дефицит серина. См. значения
встречаемости в вышеприведённой схеме.
3.
Ключевая АК должна обладать свойством инициализации процесса
сополимеризации с L-изомерами других АК, т.е. относиться к разряду
спиралеобразующих.
Свойство «левых» аминокислот включаться в a-спирали известно (4),(7),(8) (неже цитирую) и проверено экспериментально : «свойства аминокислоты, стоящей в конце растущей цепи, определяют выбор последующей» и «…если в среде преобладали L-аминокислоты, то даже немногие присутствовавшие в системе молекулы D-аминокислот в состав синтезировавшихся полипептидов не включались». Сказанное понятно и по энергетическим и энтропийным соображениям.
4. Иметь в определенных природных
условиях более стабильный L-изомер по сравнению с ее же D-изомером.
Иными
словами должны сочетаться свойства выбранной молекулы с неким асимметрическим
природным фактором, действующим за время достаточное для стабилизации
нарушенного энантиомерного равновесия. Кроме этого D-изомер должен блокироваться в отношении процесса
рацемизации. Это, четвертое, требование наиболее жесткое и именно оно позволяет
выбрать ту самую первую молекулу, с которой начался этап биологической
эволюции. Условно можно принять, что химический этап закончился с появлением
аминокислот.
Полагая
алифатические АК производными глицина и серина, т.е. вторичными продуктами, и
исключая глицин, как молекулу, не имеющую оптических изомеров и не
способствующую спиралеобразованию, остановим выбор на молекуле СЕРИНА и
рассмотрим возможность самоорганизации биогенных молекул с учетом особенностей
серина в конкретных внешних условиях.
" "
"
Механизм
нарушения зеркальной симметрии
под действием грозового
разряда.
В
работах В.А.Гусева (5),(6) предложен механизм синтеза органических
соединений и, в частности, аминокислот
в водяных каплях первичной атмосферы под действием электромагнитного поля
молнии. Полученный интегральный результат по всем органическим соединениям понуждает к дальнейшему анализу отдельных химических реакций.
Представляет интерес исследовать образование и «поведение» молекулы серина и механизм молекулярной самоорганизации в части нарушения L-D –
симметрии. Развивая идею химической
эволюции в грозовом облаке, рассмотрим физику процессов в зоне молнии с учетом
особенностей выбранного кандидата на роль ключевой молекулы – молекулы серина.
Одна из особенностей ключевой молекулы -
СЕРИНА – наличие прототипа биологической функции, обеспечивающей конформационную
определенность и однозначность в процессе молекулярной эволюции – начале биогенеза.
Расчет молекулы серина
произведен полуэмпирическим методом РМ3 в пакете программ WinMopac 7.21. Метод РМ3 был выбран по
следующим причинам: метод
параметризован для болшого числа элементов и хорошо считает молекулы,
содержащие кислород и азот; в методе минимизирован учет нековалентного внутримолекулярного расталкивания. В качестве исходной использовалась молекула,
построенная четырьмя способами: в программе
HyperChem 5 из атомов;
в этой же программе достройкой
молекулы аланина; и из фрагментов L- и D-серина (банк данных программы) с последующей оптимизацией
геометрии прграммой молекулярной механики ММ+. Независимо в пакет WinMopac вводилась Z-матрица серина с использованием стандартных значений связей
и углов алифатических аминокислот. Оптимизация геометрии приводила к совпадению
моделей во всех четырех вариантах (Рис. 1).
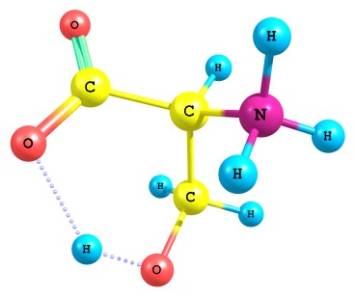
Рис.1 - визуализация программой ChemCraft
результатов расчета L – серина
Показано образование
квазицикла C==O---H--O¾C¾C.
С учетом конформационной
гибкости молекулы серина были рассчитаны модели с различными положениями групп
-СН2ОН и -СООˉ. При совпадении плоскости СООˉ с направлением связи CN в отсутствии внешнего
асимметрического фактора квазицикл не образовывался. Когда же связь CN и плоскость СООˉ
оказывались взаимно перпендикулярными,
квазицикл замыкался водородной связью лишь при благоприятной ориентации
ОН-группы с учетом её практически свободного вращения.
Условия, в которых находятся капли влаги, с имеющимся или синтезируемым серином, определяются природой грозового разряда. Импульсы тока (i ~ 10^4 A) создают радиально симметричное магнитное поле В, действующее в течении времени τ ~ 10^ - 4 с, что значительно превышает время внутримолекулярных перегруппировок (~ 10^-11 с) и позволяет считать поле во время таких перегруппировок постоянным.. Канал молнии (диаметр до 40 см) «взрывается», что приводит к возникновению мощной ударной волны, увлекающей каплю с органической “начинкой” в радиальном направлении, т.е. перпендикулярно и вектору тока молнии, и вектору магнитной индукции (Рис.3 и 4). Таким образом, капля и молекулы в ней за время грозового разряда движутся перпендикулярно силовым линиям магнитного поля как минимум со звуковой скоростью.
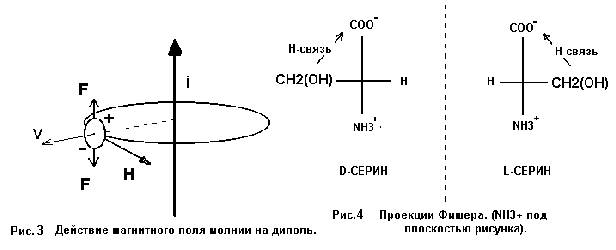
Молекула
серина, представляющая собой диполь (СОО¯….. NH3+), при движении в магнитном поле
под действием возникающей пары
Лоренцевых сил F развернется так, что
ось диполя примет положение, перпендикулярное как вектору индукции магнитного
поля В, так и вектору скорости V. В программе WinMopac
действие магнитного поля качественно учитывалось при формировании Z-матрицы. В частности, задавалась
увеличенная Лоренцевой парой FF
до 125-130 градусов величина угла С-С-N. При последующих расчетах это
значение фиксировалось введением запрета на коррекцию угла, чем и определялось
действие магнитного поля во время внутримолекулярных перегруппировок. Итогом
расчетов методом РМ3 для всех конформаций серина были молекулы с квазициклом ( Рис. 1 ) и водородной связью
(расчетная длина связи » 1.8 ангстрем). В пользу образования Н-связи свидетельствовал
ряд изменений физических параметров молекулы. Теплота образования изменялась на
~24 ккал/моль, на столько же увеличивалась энергия межъядерного взаимодействия
(Core-Core Repulsation). Уменьшение частот валентных
колебаний связей ОН и СО на ~600 и ~60 смˉ¹ соответственно,
характерное для молекул с водородной связью СО----О-Н (расчет колебательных
спектров методом молекулярной динамики в пакете HyperChem 5) позволило идентифицировать
энергию ~24 ккал/моль как энергию водородной связи. Этим же методом определена
10-и процентная ковалентность ОН-связи. Значительная энергия, большое смещение
частоты валентных колебаний и частично ковалентный характер возникшей связи
допускает предположение о частичном обобществлении протона кислородами
квазицикла.
Кроме сказанного отметим, что формирование квазицикла в молекулах L и D серина обусловлено строением промежуточного соединения – R-аминонитрила – в реакции Штреккера. Возможные конформации этой молекулы изображены на рисунке 5.
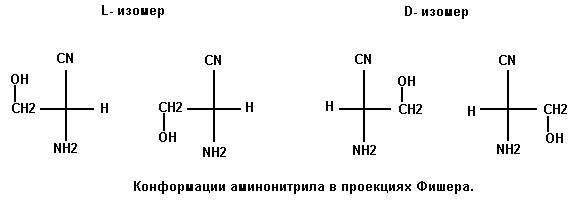
Рис. 5
Допускается еще один конформер с
ОН-группой, расположенной в сторону от связи
CN – C – NH2. Однако, эта структура неустойчива и переходит в одну из
показанных. Для определения, какая из них ведёт к образованию квазицикла в
молекуле серина, проведен расчет оптимальной геометрии молекулы
полуэмпирическим квантово-механическим методом MNDO. Этот метод параметризован для лучшего
определения геометрии и в пакете HyperChem широко
используется. Расчеты показали, что структуры R-аминонитрила
с ориентацией группы ОН в сторону CN как у L так и у D изомеров обладают меньшей
полной энергией по сравнению с изомерами, у которых ОН-группа ориентирована в
сторону NH2:
L- и D-Rаминонитрил с ОН-группой в сторону CN E = 1130.52 ккал/моль.
L- и D-Rаминонитрил с ОН-группой в сторону NH2 E = 1131.98 ккал/моль.
Расчет и оптимизация в пакете WinMopac 7.21 методом PM3 для любой конформации в итоге приводит к структуре с ориентацией
ОН-группы в сторону нитрила (Рис. 5).
Разница Δ = 1.46 ккал/моль больше кТ (0.6 ккал/моль при 298 К). Капли в грозовой туче находятся при пониженной температуре и бывают в переохлажденном состоянии. Потенциальный барьер вращения вокруг С – С связи порядка 3 ккал/моль. Это все вместе и обеспечивает стабильность R-аминонитрила с предпочтительной для образования квазицикла серина ориентацией ОН-группы.
Таким образом, серин, в конечном
итоге, синтезируется из конформеров R-аминонитрила с
благоприятным для образования квазицикла строентем.
Можно объяснить ориентацию молекулы серина, используя классическое
рассмотрение поведения движущейся системы зарядов в магнитном поле. В общем
виде задача достаточно сложна и система дифференциальных уравнений движения не
имеет аналитического решения. При фрагментарном подходе к анализу, выделяя и
рассматривая отдельно протон ОН-связи, можно предсказать отклик квазициклов
изомеров серина на действие асимметрического физического фактора молнии « B, E,
V ».
В системе взаимодействующих зарядов под действием Лоренцевых сил каждый атом будет прецессировать и это приведет к сложному колебательному движению связей молекулы. Результирующее движение можно рассматривать как прецессию диполя в случае полярных молекул, либо молекул с наведенным диполем. Поверхность вращения представляет собой соединенные вершинами соосные конусы.
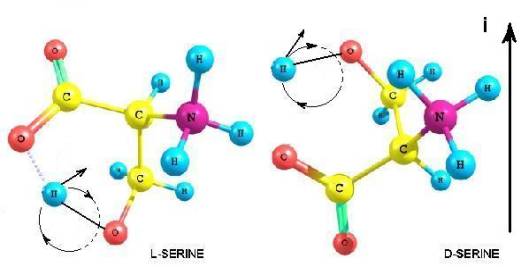
Рис. 6
Классическй
расчет магнитного момента (р=q٭v٭R/2,
где q-заряд
на конце диполя, v-скорость
движения диполя в поле и R-
Ларморовский радиус) серина приводит к
условию: магнитный момент прецессирующей
отрицательной области больше магнитного момента прецессирующей положительной
области. Это и определит ориентацию молекулы серина, а именно разворот молекулы в соответствии с направлением
результирующего магнитного момента. Область с группой NH3+ окажется ориентированной
преимущественно в сторону канала молнии, а квазициклы L-
и D-серина будут составлять с вектором магнитной
индукции угол, близкий к 90 градусам
(Рис. 6).
Для
случая ковалентно связанных протонов вращения в чистом виде не будет. Магнитным
полем возбудится сложное валентно-деформационное колебание с частотой
γ = q٭μ٭i / (2π)²٭m٭r,
где q – заряд
протона, μ – магнитная
проницаемость для вакуума, i – сила тока
молнии, m – масса протона и
r – расстояние до
канала молнии.
Полученное значение γ ≈ 3٭10^6 / r , сˉ¹
на несколко порядков меньше частот собственных колебаний связей молекул
и, тем самым, позволяет исключить процесс резонансной перекачки энергии
магнитного поля и разрушение молекулы на расстояниях r > 10^-6 м.
Таким образом, окружающие канал капли влаги и молекулы в них подвержены
лишь Лоренцевым воздействиям. В случае водородных связей в квазициклах
серина произойдет вывод протона из
контура квазицикла D-изомера, именно
из положения наибольшего удаления от «своего» кислорода. Водородная связь
разрушится. У изомера L - картина обратная: протон будет удерживаться Лоренцевой силой в
квазицикле ( Рис. 6).
Разблокирование группы
СОО¯ с одновременным увеличением
угла С-С-N приведет к перебросу одного из
протонов группы NH3+ на группу СООˉ, превращению ее
в карбоксил СООН и восстановлению
реакционной активности. Поведение
отдельных фрагментов молекулы в силовом поле скелета рассчитано в пакете WinMopac. Действительно, при выводе ОН-связи из контура
квазицикла (D-серин) расчёт подтверждает переброс
протона. Следствием этого будет гибель
именно D-изомера и, следовательно, кнарушение
рацематного баланса в пользу L-серина. За время действия
грозового разряда произойдут миллионы
таких событий и все капли, падающие на
поверхность Земли, будут содержать серин преимущественно в L-форме, то есть представлять собой в значительной степени
хиральную среду. Имеет место своеобразная самоорганизация хиральности. Выше изложенное является основанием для
выделения уникальной особенности серина – наличие прототипа биологической
функции, обеспечивающей конформационную определенность при биогенезе.
Привлекательна идея об органическом синтезе в каплях грозового облака,
предложенная В.А. Гусевым (5).
Согласно этой гипотезе в протонизированных
каплях под действием электромагнитного поля молнии происходит порядка 10^10
реакций синтеза за время одного разряда. Синтезированные молекулы, имеющие
дипольный момент (в частности аминокислоты), выстраиваются в цепочки по
радиусам, т.к. электрическое поле центрального протонного облака сферически
симметрично.
Рациональным
будет обобщение механизма образования олигомеров АК (В.А. Гусев) и механизма
стабилизации L-серина
(А.В. Керимбеков) На капли, находящиеся
на расстоянии, например, 1 метр от канала молнии электромагнитное поле начинает
действовать через 3*10^-9 секунды. Эти же капли придут в движение только через
~ 10^-3 секунды и уже будут содержать органические молекулы. Канал молнии
формируется примерно тридцатью разрядами за время ~ 10^-4 с и на движущуюся
каплю подействует магнитное поле второгго и всех последующих из, примерно, 30
разрядов одной молнии.
Таким
образом, среди синтезированных молекул, наряду с алифатическими и, возможно,
серосодержащими АК, образуется L-серин, инициирующий
LL-сополимеризацию
цепочек АК. Порядок расположения АК в цепочках при
приблизительно одинаковых дипольных моментах (D) может определится их молекулярными массами.
Метионин (Мол. мас. 149) окажется дальше всех от центра капли, т.е. в конце цепочки.
Далее: у простейших АК вектор D практически
лежит внутри пирамиды ядра АК – параллельно линии, соединяющей NH3 и СОО.
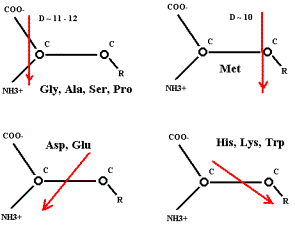
У
метионина вектор D
значительно вынесен в сторону радикала и проходит через первый углеродный атом
радикала на расстоянии ~ 1.5 Å от альфа-углерода. Если в капле и
образуется Met,
то он, возможно, блокирует процесс полимеризации. (Выводит свою группу NH3 из линейной зоны активации при действующем поле протонов). Этим,
вероятно, можно объяснить положение Met в белковых молекулах: элонгация пойдёт в направлении N Ò C. В водоёмы попадают короткие L-полипептиды с молекулой L-метионина на N-конце. Но это всего–навсего предположение!
Рис. 7.
----------------------------------------------------------------------------------------------------------------------------
В
меньшей степени вектор дипольного момента смещён в сторону R у Phe, Val, Leu, Ile.
Известны варианты начала трансляции: UUG, GUG, CUG, AUU, AUA, соответствующие этим АК.
"""
Дальнейшее развитие процесса и механизмы закрепления результата
Существует по меньшей мере две основных модели первичной атмосферы
Земли. В одной из них основу составляют пары воды, метан (CH4) и аммиак (NH3); в другой допускается
присутствие водорода, азота, углекислого газа и сероводорода в конкурирующих
концентрациях. Общим и достаточно надежным фактом принято считать отсутствие
кислорода. Временной интервал с значительно размытыми границами между «началом»
абиогенеза и появлением кислорода в атмосфере составляет примерно миллиард лет.
По первому варианту из
перечисленных компонентов в газовой фазе (межкапельное пространство облаков)
образовывались простейшие органические соединения, в частности простые альдегиды
и цианистый водород:
СН4 + Н2О ----> H2CO + 4H+
CH4 +
NH3 ----> HCN + 6H+ . (1)
Реакции скорее всего протекали по ион-радикальному механизму:
СН3 + ОН
-----> H2CO + H2
CH3 + N ----->
HCN + H2. (2)
Акцент на эти соединения
поставлен ввиду их последующего участия в образовании простейших аминокислот
(АК).
Реакция образования АК могла протекать как в газовой фазе, так и в каплях и на их поверхности.
RCHO +
NH3 ’ NH3+`RCH`COO¯ (3)
HCN
При газофазном синтезе простейшие АК адсорбировались
отрицательно заряженными каплями влаги. Возможен и более вероятное, по моему
мнению, место протекания реакции 3 – на
поверхностях капель. Этому способствует градиент электрического потенциала в
приповерхностном слое заряженных капель.
Помимо реакции 3 в каплях возможна реакция АК с формальдегидом
(реакция Сёренсена) и на этом следует остановиться особо. В водной среде
процесс контролируется диффузией и взаимодействие образовавшегося серина с
формальдегидом сразу после «появления» молекулы серина в поверхностном слое
невозможно, т.к. в «точке» реакции формальдегид израсходован на стадии синтеза
серина. Серин оказывается в коконе из молекул воды - образуется кластер.
Формальдегид непременно сразу же встретится с ионом гидроксония либо с другими
молекулами формальдегида и образует тример (триоксан), либо сополимеризуется с себе
подобными (особенно при температуре ниже 100 градусов), либо разрушится светом
с λ < 350 нм. Известны и другие реакции
формальдегида с молекулами растворенных в капле газов (например с молекулами
аммиака). В итоге число встречь формальдегида с серином будет в разы меньше
числа встречь, дезактивирующих формальдегид.
Примеси в каплях в виде ядер конденсации не играют роли. В
грозовых тучах (кучево-дождевые облака) концентрация капель достигает 10^3 в см. куб. Капли образуются на ядрах
конденсации – частицах и ионах вулканического происхождения. Общепринятое
значение концентрации вулканических частиц в атмосфере так же порядка 10^3 в см. куб. В каждой капле, таким образом,
может содержаться лишь несколько «пылинок» и их ролью в рассмотренных реакциях
можно пренебречь.
Скорость наработки
формальдегида при пересчете данных, приводимых М.Е.Акопяном (1) равна
v(F) = 10^4 молекул / см ³ с.
В соответствии с принципом квантовой
эквивалентности можно допустить одинаковую скорость наработки как CH2O, так и HCN в атмосфере. Тогда в
поверхностном слое капли синтез простейших АК будет протекать со скоростью того
же порядка. «Таким образом, для наработки массы органических соединений, равной
совремённому годовому производству органического вещества в процессе
фотосинтеза, необходим небольшой промежуток времени ~ 10^5 – 10^6 лет» (1).
Второй вариант состава атмосферы (азот, двуокись углерода, пары
воды, сероводород) использован в модели Гусева. Как сказано выше, в каплях
синтезируются короткие (до нескольких десятков аминокислот) полимерные цепочки
из левых АК и в опаринских коацерватах энантиомерное равновесие будет
нарушено на стартовой позиции последующих кооперативных процессов синтеза.
Рассмотрим продолжающийся
процесс сополимеризации L-серина с другими
аминокислотами (АК), в первую очередь с простейшими алифатическими. Исключая далее «погибший» в магнитном поле
молнии D-серин, проведем
расчет разности энергий образования L(S)-L(AK), L(S)-D(AK) и D(AK)-L(S) димеров, где L(S) – L-серин.
Оптимизация геометрии и расчет энергий димеров выполнен программой HyperChem 5 методом MNDO. (
Этот метод параметризован для лучшего учета геометрических параметров). Результаты
приведены в таблице.
Разности энергий образования в ккал / моль
для ряда димеров.

Для иллюстрации аналогичного явления в тримерах проведен расчет L-L-L и L-L-D серинов. И в этом
случае сополимер только с L-изомерами более
энергетически выгоден, чем L-L-D. ∆
= 3.08 ккал/моль. О селективной сополимеризации говорилось выше (4), (7), (8),
но полезно было провести расчет для ключевой молекулы – серина.
На основании этих расчетов можно
предположить, что процесс сополимеризации носил энантиоселективный характер.
Развитие процесса привело к накоплению олигомеров с L-аминокислотами и к следующим уровням
самоорганизации молекул.
Подводя итог предположениям,
доказательствам и расчетам, можно сделать следующий вывод:
В течение сотен
миллионов лет с начала первых шагов абиогенеза ключевая молекула – СЕРИН – под
действием грозовых разрядов сохранялась в L –форме, накапливалась в шельфовой зоне и
в лагунах. Взаимодействуя с соответствующими соединениями, серин стал
непременным компонентом синтеза других АК и инициатором энантиоселективной LL- сополимеризации. В этом, по сути, и
есть разгадка тайны L – жизни, т.е. тайны строения
белков из «левых» аминокислот.
Можно с
определенной осторожностью постулировать следующее: невозможность «D-жизни» следует из преобладания на молекулярном уровне
для аминокислот процессов LD → L над процессами LD → D в соответствии с
физическими законами для ВЕЩЕСТВА.
Литература к разделу «нарушение
энантиомерного равновесия».
1.
М.Е. Акопян, Соросовский
образовательный журнал, №1, 1999 г.
2. В.В. Племенков, Химия и компьютерное
моделирование, Бутлеровские сообщения, №2, 2003 г.
3.
Сайт: http://jabad.narod.ru/002/004/0001.htm
4.
Р.И. Хильчевская: http://ttizm.narod.ru/gizn/rolasim.htm
5.
В.А. Гусев, Доклады РАН, v. 385, №3, 2002
6.
В.А. Гусев, Биофизика, т. 46, вып. 5, 2001
7. L.E. Orgel. J. Mol.
Biol., 38, 381, 1968
8.
S.W. Fax, K. Harada. J. Amer.Chem. Soc., 82, 3745, 1960
9.
http://web.ru/db/msg.html?mid=1161552&uri=page=21.html
10. http://www.biomedcentral.com/1471-2148/3/12 Возврат в начало
"""
Проблема происхождения и свойства
генетического кода.
Ранее
В.А. Гусевым предложена и обоснована модель образования полимерных цепочек
аминокислот (АК) в каплях грозового облака (1, литература к этому разделу).
Динамика синтезированных простейших молекул АК такова: «Молекулы, обладающие
собственным дипольным моментом, будут втягиваться в центральную зону капли
из-за неоднородности центрально-симметричного поля ленгмюровских протонов» -
цитата из работы (1). В поле сгустка протонов молекулы выстроятся в
цепочки. Энергии протонов, совершающих колебания в электромагнитном поле
молнии, оказывается достаточной для активации гомогенных химических реакций, в
частности, для активации СОО¯-групп АК. Происходит ковалентная сшивка
молекул АК с образованием пептидных связей. В итоге за несколько микросекунд
возможно образование олигомеров до нескольких десятков АК, ориентированных
вдоль радиусов капли.
Среди простейших АК равновероятно образование и
ключевой молекулы серина, который вступат в процесс сополимеризации в
L-форме и инициирует именно
LL-сополимеризацию. В каплях при LL-сополимеризации ковалентной сшивке АК способствует
ориентация дипольных моментов.
В опаринском бульоне олигопептиды
участвуют в процессах самоорганизации и сопряженных кооперативных процессах с
молекулами азотистых оснований, сахаров и полифосфатов. Процесс сополимеризации
аминокислот и хирализации среды
инициируется молекулой L-Серина.
В простейшем случае
биоорганических молекул – аминокислот -
неминуемо образуются олигопептиды с последующей рекомбинацией и
компактизацией по схеме клубок ® глобула.
Самоорганизация олигопептидов
ведёт к «выживанию» белковоподобных структур – простейших протобелков.
Полипептидные цепи, последовательности АК
в которых подобны белковым, способны переходить во вторичные, третичные
структуры с наивыгоднейшей конфигурацией за наименьшее (по сравнению с
«сородичами») время. Парадокс Левинталя
устраняется тем, что происходит не перебор вариантов, а преобладание
предпочтительных вариантов, ведущих к белку – компактной структуре. Подробно в
книге А.В.Финкельштейна и О.Б.Птицина «Физика белка» (http://kdu2001.narod.ru/g_belok.html).
В результате процесса самоорганизации логично ожидать формирование ограниченного
числа структур с конкретными функциональными
свойствами. Ограничения вызваны,
в частности, соображениями компактности конечной структуры, высотой барьера на
пути формирования стабильной структуры и пригодностью ограниченного набора АК
из многих (» 200). Стабильность нативных структур при «высоких»
«биологических температурах» должна преобладать над стабильностью небелковых
полипептидов. «Неправильные» структуры могут играть роль строительного
материала – пищи, а могут и встраиваться в пептидную последовательность.
Формально есть два варианта формирования
последовательностей нуклеотидов в НК:
1. «Сборка»
совершенно случайной последовательности.
2.
«Сборка» по правилам – целевая сборка.
Вариант «1» - формирование случайных последовательностей
нуклеотидов – приводит к бестолковому
многообразию просто полипептидов, не обладающих свойствами белков.
Вариант «2» - наиболее дискуссионный. Кто и
где записал эти правила?
Но это на первый взгляд, в согласии с центральной догмой ДНК â
РНК â
Белок , которая безусловно справедлива, но справедлива, только как формула
совремённого этапа эволюции.
Томас
Р. Чак: http://travel.kotomsk.ru/gro/rna/rna.html
«Некоторые
исследователи полагают, что открытие аутосплайсинга и природы ферментативной
активности рибонуклеазы Р разрешило долгий спор о том, что раньше возникло в
эволюции: яйцо или курица — нуклеиновые кислоты или белки. Открытие того, что
интрон тетрахимены обладает некоторой способностью к синтезу РНК, ставит
гипотезу о первичной роли РНК на более прочную основу, поскольку
свидетельствует о возможности (по крайней мере, в принципе) аутокаталитической
репликации РНК. Теперь уже разумно предполагать, что первым шагом к
возникновению жизни была репликация РНК без участия каких бы то ни было
белков».
«ФОРМИРОВАНИЕ» ГЕНЕТИЧЕСКОГО КОДА.
В цитате последнее утверждение –
«без участия каких бы то ни было белков» - можно оспорить. Для этого и с целью
установления кодон-аминокислотного соответствия рассмотрим некоторые особенности ГК, опираясь предварительно на
детерминированное значение 4 азотистых основания и, постулируя гипотетический
механизм: Параллельные
сопряженные процессы при кооперативном синтезе олигопептид - олигонуклеотид
приводят к «отражению» АК-последовательностей на последовательностях
нуклеотидов. Хемосорбция аминокислот на растущей нуклеотидной цепочке
продолжается гетерогенными каталитическими реакциями сополимеризации АК.
Осуществляется запись (кодирование) белками самих себя. Выделим некоторые фундаментальные
особенности генетического кода в виде следующих вопросов:
1.
Почему природой выбраны 20 аминокислот?
2. Почему значения вырожденностей 1, 2, 3, 4 и 6? Почему нет
значения 5?
3.
Как распределены эти значения между АК?
4. Почему некодирующие триады (нонсенс-кодоны) UAA, UAG, UGA и почему их 3? (диалекты ГК не рассматриваются).
В большинстве работ по генетическому коду,
анализируемых В.Гусевым (1), кодон-аминокислотное соответствие рассматривается
с использованием физико-химических взаимодействий нуклеотидов и аминокислот. Однако,
физико-химические параметры, такие, например, как полярность, кислотно-основные
свойства аминокислот и кодонов зависят от физико-химических свойств среды.
Соответствие, возникающее только на их основе, не может быть определённым,
будет зависить от внешних условий и приведёт к неоднозначности кодирования. Определяющими,в первую очередь,служат стереохимические параметры аминокислот и кодонов.
Соответствие, вероятнее всего,
детерминировано.
Предположение о
детерминированном Генетическом коде (ГК) высказано в работе В.А. Гусева Victor A.Gusev & Dirk Schulze- Makuch, Physics of Life Reviews, v.1, dec. 2004, 202 – 229: «генетический
код не является продуктом ни химической, ни предбиологической эволюций – химические
структуры 4-х нуклеотидов, 20-ти канонических аминокислот и отображение
множества триплетов на множество аминокислот
детерминированы, также как детерминирован набор элементарных частиц и
химических элементов самим актом рождения наблюдаемой Вселенной».
Однако, такой глобальный детерминизм
требует подробного рассмотрения. Выяснение природы кодон-аминокислотного
соответствия, как основы Генкода, позволит понять истоки действующих закономерностей и выделить категорию аргументов во взаимодействующей
системе молекул аминокислот и азотистых оснований.
Кодон-аминокислотное
соответствие, как основа ГК, детерминировано в том смысле, что состоит из
отдельных частных детерминант. Код проявился автоматически для четырёхбуквенной
символьной последовательности и отобранного в процессе эволюции белков набора
20 протеиногенных аминокислот. Свойства этого набора и свойства символьной
последовательности регламентировали предельно возможное число аминокислот
значением 20 – 22 и определили кодон - аминокислотное соответствие.
Совершенствование способа реализации генетического кода в процессе эволюции, отдельные контекстные
особенности, диалекты, механизм трансляции, в работе не рассматриваются.
В основе кодон-АК соответствия должен лежать
один из возможных для обеспечения однозначности принципов распознавания:
1. арифметический целочисленный –
нумерологический,
2. стереохимический типа
«ключ-замок»,
3. оба эти принципа, действующие последовательно по условию “ if – then”,
4. некий не установленный фактор
соответствия…
"""
СВОЙСТВА СИМВОЛЬНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ.
Если имеется символьная
последовательность, например из четырёх символов U, C, A, G (…AUUCGUAAUCGGA…), то свойства таблиц из символов
определятся размером кодового слова.
Кодовые слова могут быть сопоставлены
любой группе объектов. Если эта группа
объектов неоднородна, то и сопоставление будет иметь неоднородную
кратность. Установленное соответствие будет кодом, в частности, Генетическим.
Свойствами таблицы определится число кодируемых объектов, вырожденность
кода и «кодон – объектное соответствие».
Существует несколько вариантов записи
«кодон – объектного» соответствия: прямоугольная таблица совремённой версии
Генетического кода (ГК), ромбический вариант, круговая диаграмма, некоторые
более сложные пространственные построения. Таблицу (удобнее всего!) составляют
из квадруплетов, именуемых первыми двумя буквами трёхбуквенных позиций, когда
мультиплетность кода равна 3.
В случае различия символов по свойствам
можно присвоить символам последовательности произвольные числовые параметры,
например, 1, 2, 3, 4. Если условиться, что параметр имени квадруплета равен
сумме параметров входящих в него символов, то таблица будет иметь распределение, соответствующее этим параметрам . Не нарушая
общности, символы U, C, A, G можно считать азотистыми основаниями
и присвоить им значения сил оснований
по Румеру (2) или коррелирующие с ними внутренние энергии азотистых оснований.
Значения энергий получены для имён (первые
две буквы – символа) квадруплетов приближенно методом оптимизации геометрии MM+ ( HyperChem 5 ) и показаны в
произвольных единицах (Рис. 8). По
Румеру (2) силы оснований: d(C) = 4, d(G) = 3, d(A) = 2, d(U) = 1. Силы дублетов находятся как суммы, а это
приводит к ложным симметриям из-за предположения об аддитивности. Поэтому лучше
использовать для имен квадруплетов «СИЛЬНЫЙ» и «СЛАБЫЙ» (Рис. 9).
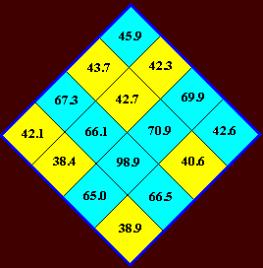
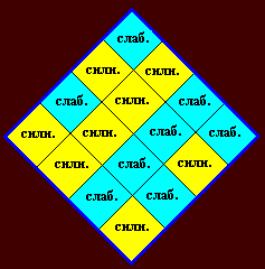
Рис. 8.
Рис. 9.
Из таблиц квадруплетов следует: символьная
последовательность способна выделить из группы объектов, по крайней мере, две
подгруппы. БЕЗОТНОСИТЕЛЬНО К ПРИРОДЕ ОБЪЕКТОВ! Одну, n объектов –
соответствующую квадруплетам с высокой энергией ( 45.9 – 98.9 ), другую, m объектов, соответствующую квадруплетам с низкой энергией ( 38.4 – 43.7 ). В первую
подгруппу (бирюзовые квадруплеты) попадёт
8 квадруплетов не зависимо от выбора в качестве параметров энергии, или
силы оснований, во вторую (желтые
квадруплеты) – также 8
квадруплетов. Неопределённость в отношении квадруплетов GU, UG, UU может быть
частично устранена для UU: по силам оснований и по
энергии он относится к первой подгруппе*. В отношении GU, UG (энергии:
42.1 и 42.6, соответственно) смотрите ниже.
Предположим самое простое: «объект –
кодонное» соответствие проявляется (именно, ПРОЯВЛЯЕТСЯ, как, например, Закон
Ома, как только есть заряды, ЭДС и проводник)
при «контакте» объекта с участком символьной последовательности, или её
фрагментом ( по принципу « подходит – не подходит» ). В случае триплетного кода
контакт с двумя или тремя символами – буквами
(Рис. 10).
Предположим далее, что взаимное
распознавание кодон – АК осуществляется в два этапа: во первых, по
специфическому биполярному основанию аминокислоты идентифицируются именно
молекулы АК из многообразия молекул субстрата, во вторых - идентифицируются отдельные молекулы АК.
Таким образом первоначально превалирует
тенденция к кодированию двумя первыми буквами – двумя нуклеотидами.
âââ Свойство сортировки заложено в самой символьной
последовательности. Проявляется это свойство при установлении числа
различающихся символов, размера
кодового слова и идентифицируется
таблицей.
"""
ЧИСЛО
КОДИРУЕМЫХ ОБЪЕКТОВ. ПРИМЕНЕНИЕ
АЛГЕБРАИЧЕСКОГО ФОРМАЛИЗМА К АМИНОКИСЛОТАМ.
ПРОБЛЕМА 20-и АК.
Рассмотрим регулярную последовательность символов U, C, A, G, характеризуемую шагом h. Кодируемая группа состоит из N объектов a(i) и b(j). Условимся о свойствах этих объектов:
и a(i), и b(j)
избирательно соответствуют (кодируются) наборам букв
последовательности. В этой группе:
m объектов a(i), размер
(длина) которых приблизительно равна
шагу последовательности h,
L »
h,
n
объектов b(j), размер (длина) которых приблизительно равна 2h
h < L » 2h.
Размером объекта b(j) определится кратность кодового слова (
набора букв из последовательности U, C, A, G ). При
выбранных условиях код оказывается ТРИПЛЕТНЫМ, по крайней мере, для объектов b(j). Для кодирования объектов a(i) достаточно двух букв. (Рис. 10)
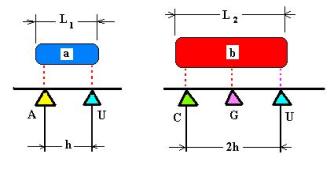
В стандартной таблице четырёхбуквенного ( пока
не генетического! ) кода (4^3 = 64 буквенных триплета – позиции) m объектов из a(i)
займут по четыре триплета (кодирование именем квадруплета), то есть
будут иметь вырожденность кодирования, равную четырём.
Рис. 10.
Рассмотрим предварительно случай с
возможными значениями вырожденности 1, 2, 3 и 4*** для всей группы. Кодирование, а, следовательно, и декодирование (чтение, перевод ) для обеспечения смысловых результатов должно
быть непрерывным, последовательным и включать сигналы начала и окончания
процесса**.
Запишем: m объектов из a(i) с вырожденностью 4 займут 4m позиций из 64-х.
На долю объектов из b(j)
останется n' = 64 – 4m
позиций (триплетов).
Число объектов из a(i) и b(j)
N = m + n.
Тогда для
общего числа позиций (64): v(m)*m + v(n)*n =
64, где v(m) и v(n) – значения вырожденностей кода для a(i) и b(j), соответственно. Поскольку значение v(m) = 4 «использовано», то для v(n) примем среднее из оставшихся, 1, 2,
3. То есть V(n) = 2.
![]() Из простой
системы 4m + 2n = 64
Из простой
системы 4m + 2n = 64
m +
n = N 5,
получим соотношение для числа кодируемых
объектов:
âââ N = 32 - m 6,
n и m связаны
соотношением m + n/2 = 16 7.
Полученные результаты
согласуются со свойствами
четырёхбуквенной символьной последовательности с триплетным кодовым
словом. Сопоставим компактные объекты,
кодируемые двумя буквами (m штук с размером L » h) квадруплетам с низким значением
энергии. Поскольку для этой подгруппы объектов кодирование двухбуквенное, то
число квадруплетов будет равно числу объектов:
m = 8,
(Рис. 8 и 9). В m
включён квадруплет GU
по значению энергии (42.1).
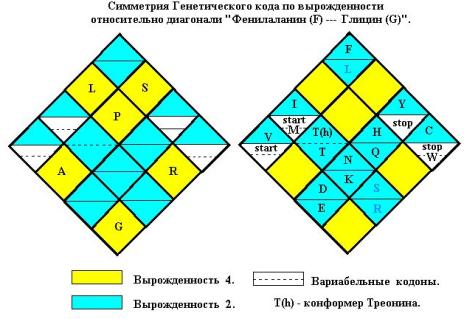
Рис.11.
Сопоставление распределения энергий квадруплетов со значениями вырожденностей
в совремённой версии универсального генетического кода приводит к симметриям
как для аминокислот, так и для нонсенс-кодонов (Рис. 11). Квадруплет AC кодирует Треонин (Т). Но
учитывая существование конформера молекулы Т с внутримолекулярной водородной связью, вполне логично принять для
вырожденностей каждого из Треонинов (T(h) и Т)
значение 2.
Симметрично расположены и нонсенс-кодоны “stop” и “start”. Так в квадруплете
Валина (GU) один из кодонов бывает стартовым,
Метионин (M) может занимать позицию AUA, Триптофан (W)
позийию UGA.
По формуле 6 общее число кодируемых объектов N = 32 – 8 = 24. Оставшиеся 8 квадруплетов могут быть заняты
подгруппой из 16-и объектов (n = 24 – 8 = 16). Эта подгруппа состоит
из n объектов, размер которых h < L » 2h, и допускает вырожденность кода
1, 2, 3. Средняя вырожденность V(n) = ( 1 + 2 + 3)/4 = 2 и в каждый квадруплет попадёт в среднем по 2
объекта этой подгруппы.
ПЕРВОЕ ПРАВИЛО
ОТБОРА:
При триплетном
кодировании четырёхбуквенной символьной
последовательностью таблица «выделяет» из множества максимум 24 объекта и
сортирует их по размерам с различной вырожденностью кода в отношении один к
двум (m/n = ½).
"""
Выше было
показано, что число кодируемых объектов при m = 8 равно
24.
Ещё раз: кодирование, а, следовательно, и декодирование (чтение, перевод ) для обеспечения смысловых результатов должно
быть непрерывным, последовательным и включать сигналы начала и окончания
процесса - “start”
и “stop”. Учитывая обязательные знаки терминации «start» и «stop», получим для объектов a(i) и b(j)
N = 22.
Количество перекрываемых
аминокислотой нуклеотидов т.е. размер кодона, лимитируется максимальной длиной АК ( наиболее длинные Phe, Trp, Lys ~ 8 Å). Расстояние между наружными функциональными
группами стэкинг-взаимодействующих
гетероциклов нуклеотидов ≈ 4 Å (для В-формы спирали ДНК),
протяжённость кодона ~ 7 -
8 Å.
Таким образом, ни одна из
протеиногенных АК не может «перекрыть» больше, чем ТРИ нуклеотида, не нуждаясь
в четвёртом, и, возможно, отчасти этим определяется предельная мультиплетность
- триплетность генетического кода.
К
компактным АК с размером » 4Å и радикалом над ядром АК относятся: G, A, S, P, T, L, V, R.
Молекула Аргинина (R) с большим радикалом
так же отвечает этим требованиям. Цепочка СН2-групп способствует изгибу
радикала (прогр.HyperChem 5 ), он
оказывается над ядром АК. Размер Аргинина в этом случае » 4Å. Ile (I) имеет «корявый» радикал ( L »
6.8 Å ) и кодируется с меньшей
вырожденностью. Отношение размера АК к расстоянию между наружными (относительно
сахаро-фосфатной цепи) функциональными группами (шаг последовательности)
полинуклеотида для компактных АК » 1.1,
для остальных - »2.
Учитывая также две редкие (См. митохондрии позвоночных)
АК - Селеноцистеин и Пирролизин
(Joseph A. Krzycki), получим для универсальной версии генетического кода число кодируемых АК:
âââ N = 20.
В это число
входят 8 перечисленных выше компактных АК (вырожденность кодирования 4), и 12 АК, кодируемых двумя кодонами.
ВТОРОЕ
ПРАВИЛО ОТБОРА:
Подчиняясь единому универсальному алгоритму кодирования ( старт ’ запись ’ стоп ’ старт ’ чтение ’ стоп ),
четырёхбуквенная последовательность азотистых оснований кодирует 20
протеиногенных аминокислот и распределяет их по квадруплетам с высокой и низкой
энергией.
Квадруплетами с низкой внутренней энергией
кодируются 8 «компактных» АК с радикалом, расположенным над ядром молекулы.
20 – 8 = 12 аминокислот с размерами 5.8 –
8.9 Å имеют среднюю вырожденность 2 – это показано выше. На их долю
приходится 8 квадруплетов с высокой энергией, или 16 пар кодонов. Таким
образом, 16 – 12 = 4, т.е. 4 кодона окажутся свободными. Предположение об
однородной вырожденности 12-и АК не противоречит диалекту ГК, в котором
Триптофан, Метионин и Валин могут иметь вырожденность равную двум. Таким
образом:
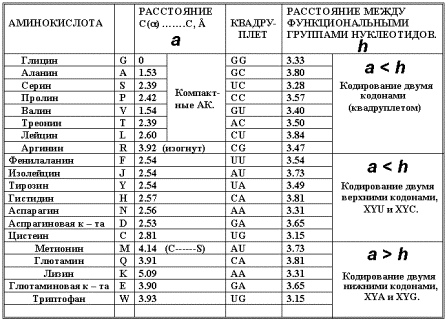
АК – G, A, S, P, T, L, V, R «занимают» квадруплеты GG, GC, UC, CC, AC, CU, GU, CG;
AK – F, I, M, Y, H, Q, N, K, D, E, C, W «занимают» квадруплеты UU, AU, UA CA, AA, GA, UG, соответственно. В первой подгруппе, как отмечено выше,
молекула Треонина (Т) кодируется как два конформера и вырожденность её кода
целесообразно считать, как 2+2 = 4. Это допущение соответствует распределению
на рис. 8 и 9. Квадруплет Валина (кодон GUG бывает в
определённом контексте стартовым) вариабелен, как и квадруплет UG.
Конкретизировать
распределение АК второй группы можно по количеству СН2-групп в радикале.
Вообще, все 20 АК можно распределить по этому параметру, используя такую форму
записи: (NH3+)COO¯- (CH2)n – R, где R – функциональная часть аминокислотного остатка
(радикала).
Тогда: для G, A, P, V, T n = 0,
для S, L, C, H,
F, Y, D, N, J n = 1,
для M, K, Q, E, R, W n = 2 ( n = 4 для K ).
Как отмечено выше, компактные
аминокислоты имеют вырожденность кода 4 и 6, и по предлагаемой классификации не
сдержат СН2-групп ( n =
0), кроме молекул Серина S, Лейцина L и Аргинина R. Молекулы аминокислот C, H, F, Y, D, N, J (n = 1), содержащие одну группу СН2,
кодируются двумя верхними кодонами квадруплетов. Молекулы M, K, Q, E, W (n = 2)
кодируются двумя нижними кодонами. Понятно и «поведение» молекул S, L, R. Как
компактные, они занимают все 4 кодона соответствующих квадруплетов, а как
имеющие СН2-группы, могут кодироваться по типу молекул из подгрупп с n = 1 и n = 2. При наличии свободных
кодонов эти АК будут кодироваться дополнительно ещё двумя кодонами.
Следовательно, вырожденность S, L, R может оказаться равной 6 – и.
Серин S и Лейцин L (n = 1) претенденты на верхние пары кодонов, а Аргинин R (n = 2) – на нижние (Рис. 11-а и таблица
1).
Природа обнаруженного свойства АК до конца
не выяснена, однако, вероятнее всего, действует фактор индукционного влияния
функциональной части радикала на основание молекул АК. С увеличением длины
цепочки СН2-групп влияние ослабевает. Возрастает роль третьего нуклеотида
кодонов.
Третье правило отбора:
(Двубуквенное кодирование)
Положение аминокислоты в квадруплете
определяется количеством СН2-групп в аминокислотном остатке (радикале), то есть
длиной цепочки, соединяющей функциональную часть радикала с основанием молекулы
(ядром). Аминокислоты C,J,N,D,H,F,Y кодируются
верхними парами кодонов типа XYU, XYC; аминокислоты Q,K,E,M,W – нижними, типа XYA, XYG. Третий нуклеотид
пары кодонов (C, U и A, G) для АК каждой
группы определяет положение АК в квадруплете. Кодирование, таким образом,
ДВУХБУКВЕННОЕ. Как следствие: легко показать, что предельно возможное число
кодируемых объектов 24.
Аминокислота
не различает U или С, А или G в третьей позиции кодона. Отличает лишь их пары, имеющие различный размер.
Кодоны AUA, AUG и UGA, UGG являются исключением из того правила – кодирование Изолейцина (AUA) и редкое кодирование Селеноцистеина (UGA). Возможно это более поздние эволюционные
корректировки Природы.
ЧЕТВЁРТОЕ ПРАВИЛО ОТБОРА.
(о вырожденности «6»)
Молекулы Серина (S), Лейцина (L) и Аргинина (R) принадлежат к группе АК с вырожденностью кода 4, но имеют
цепочки из СН2-групп.Так как Серин содержит одну СН2-группу, то он может
дополнительно кодироваться верхней парой кодонов. Аргинин содержит три
СН2-группы и дополнительно может кодироваться нижней парой кодонов. Лейцин, в
дополнение к СН2-группе, имеет в
цепочке ещё и группу СН и, поэтому, кодируется ещё и нижней парой кодонов.
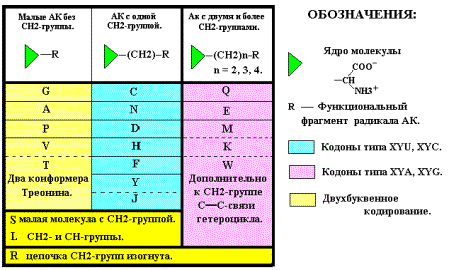
Рис. 11-а.
Таблица 1.
===================================================================
"""
Кодон-аминокислотное
соответствие.
ГЕНЕТИЧЕСКИЙ КОД И «КРЕСТИКИ-НОЛИКИ»
Распределение
квадруплетов в квадратной таблице Генетического кода (ГК) можно получить в игре
«КРЕСТИКИ-НОЛИКИ» (Tic Tac Toe)
на доске 4 х 4. Привила таковы: каждый игрок выбирает «осторожную» симметричную
стратегию с целью пометить максимальное число клеток и выиграть на последнем или
предпоследнем ходе. Игра начинается с
любой клетки, но желаемый результат получают, начиная с угла. Противник делает
симметричный относительно центра таблицы ход, а партнёр отвечает ходом на
соседнюю клетку по часовой стрелке.
(Если пронумеровать таблицу слева направо, то сумма номеров клеток двух
последовательных ходов всегда равна 17). Какая-либо иная стратегия приводит или
к преждевременному выигрышу, или к ничьей. Аналогично при начале из не угловых
клеток. Последовательность ходов
расположим в концентрических кругах против часовой стрелки, начиная с
квадруплета UG,
как показано на рисунках 12 и 12-а.
Поиграйте,
посмотрите: http://www.be300.ru/soft/data/11173/Zxan_ToeTacTic_v105.zip

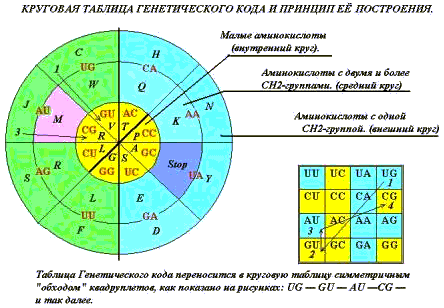
Рис. 12.
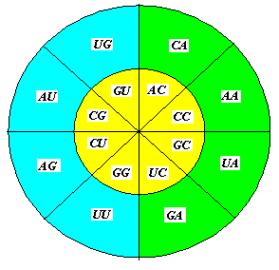
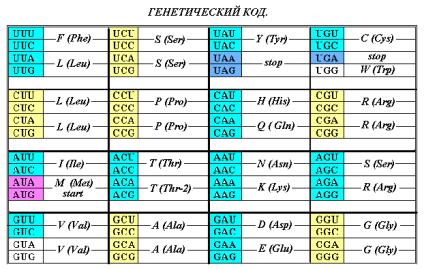
Рис. 12-а.
Рассмотренный
вариант игры применим к стандартной таблице квадруплетов совремённой версии ГК.
На рисунках показана последовательность ходов при начале из квадруплета UG. В соответствии с
распределением энергий квадруплетов (Рис. 8) условимся, что первый игрок
(начинающий из позиции UG)
«метит» квадруплеты средним значением
энергии 66 – бирюзовым и зелёным, а его партнёр – средним значением 41 -
желтым. Тогда энергии квадруплетов UU, UA,
UG, CA, AU, AA, AG, GA (бирюзовые и зелёные) будут примерно
в 1.6 раза больше, чем энергии UC, CU,
CC, CG, AC, GU, GC, GG. Отмеченная выше неопределённость UG --- GU устраняется.
âââ Таким образов, в игре с оптимальными
симметричными стратегиями происходит
сортировка квадруплетов по свойствам, соответствующая совремённой версии ГК
(Рис. 12-а, 13 и 14).
ЭВРИСТИЧЕСКИЕ МЕТОДЫ.
Установить кодон-аминокислотное
соответствие можно, пользуясь эвристическими правилами последовательно для двух групп кодонов – внутреннего и
внешнего кругов. Для этого расположим
малые аминокислоты G, A, S, P, V, T, L, R по возрастанию молекулярной массы в квадрате 3х3 по часовой стрелке через одну
клетку (Рис. 13). Размещение через
клетку обусловлено тем, что эти АК занимают как два верхних кодона, так и два
нижних, имея вырожденность кода 4. Затем «прочтём» и получим последовательность
G,S,A,P,T,V,R,L. Глицин G кодируется
квадруплетом GG (См. ниже, рис. 15 и далее).
Расположим полученную последовательность в секторах внутреннего круга, как
показано на рис. 13. Полученное кодон – АК соответствие совпадает с
генетическим кодом.
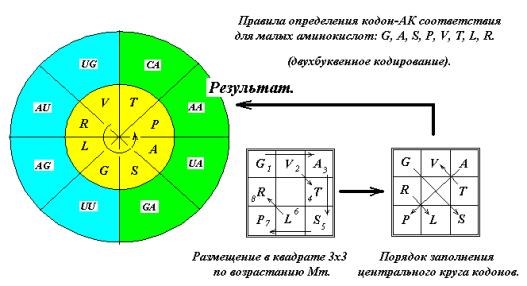
Рис. 13
К аминокислотам C,J,N,D,H.F,Y (n = 1) применим похожее правило: расположим
АК в порядке возрастания молекулярной массы в квадрате 3х3, но не через клетку,
а подряд, так как вырожденность в этом случае 2. Показанная на рисунке последовательность ходов так же приводит к
верному кодон-АК соответствию. Свободную позицию AG может занять
Серин (S) или Лейцин (L).
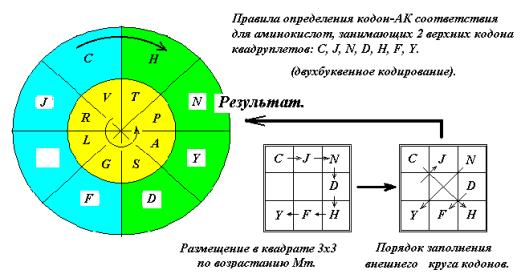
Рис.14.
ПЯТОЕ ПРАВИЛО ОТБОРА.
(эвристическое)
Кодон-аминокислотное соответствие для
аминокислот этих групп может быть установлено по эвристическим правилам…
Это изящный трюк или пища для размышлений? Случайное
совпадение для двух групп аминокислот? Маловероятно!!!
===================================================================
ШЕСТОЕ ПРАВИЛО ОТБОРА.
Оно должно ответить на вопрос о роли функциональной части аминокислотного
остатка в АК – кодонном соответствии.
Расположим
функциональные группы радикалов АК (аминокислотных остатков) в соответствующих
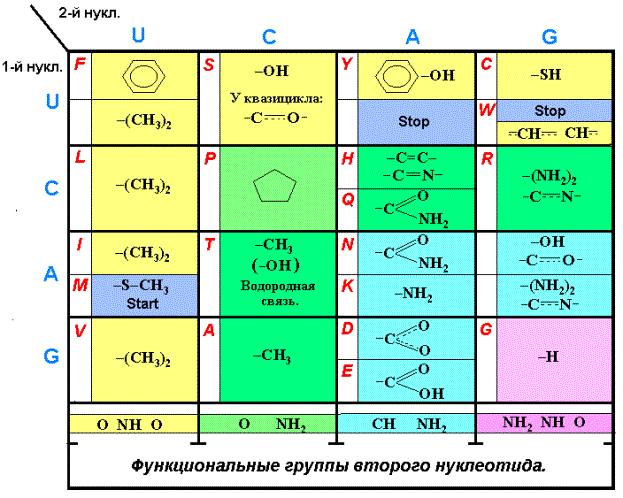
аминокислотам позициях таблицы Генетического кода (Таблица 2). В таблице синими
буквами обозначены нуклеотиды, красными – аминокислоты. Для АК Гистидина (Н),
Триптофана (W), Аргинина (R) и Серина (S) показаны двойные и полуторные связи циклов, гетероциклов и
квазицикла. Как показано выше, верхним парам кодонов соответствуют аминокислоты
с одной группой СН2, нижним – с двумя и более группами СН2.
Отметим предварительно, что Серин (S), Треонин (T) и Глютаминовая кислота (E) имеют конформеры с
внутримолекулярной водородной связью и содержат квазицикл (прогр. HyperChem 5).
Анализ таблицы приводит к следующим её особенностям:
1.
Нуклеотиду U во втором положении кодонов XUZ (первый столбец квадруплетов) соответствуют АК с двумя группами
СН3 у функциональной части радикала,
Метионин (M) (-S—CH3) и Фенилаланин (F). Квадруплеты UU, CU, AU, GU.
2.
Этому же
нуклеотиду U в первом положении кодонов UYZ (первая
строка квадруплетов) соответствуют АК с группами –OH, -SH и АК с циклами, сдержащими систему
сопряженных связей ( Фенилаланин, Тирозин, Триптофан, и квазицикл Серина ). Квадруплеты
UU, UC, UA, UG.
3.
Кодоны квадруплета UU,
находящегося на пересечении первых столбца и строки таблицы, соответствуют
АК-м, отвечающим условиям строки и столбца – Фенилаланину и Лейцину.
4.
Нуклеотиду С во втором положении кодонов XCZ ( часть второго столбца квадруплетов после Пролина)
соответствуют АК с группами –ОН , -СН3
и «копромисная» молекула Пролин. У конформера Треонина –ОН группа блокирована
водородной связью; активна, следовательно, группа СН3. Он, как и Аланин
расположен во втором столбце таблицы. Квадруплеты
CC, AC, GC.
5. Нуклеотиду С
в первом положении кодонов CYZ (часть второй строки
квадруплетов после Пролина) соответствуют АК со связями –C=C-,
-C=N-. «Копромисный» Пролин - нечто среднее между алифатическими АК и
аминокислотами, содержащими двойные и полуторные связи между углеродом и
азотом. Расположена эта молекула, соответственно, на пересечении второго
столбца и второй строки в квадруплете СС. Квадруплеты CC, CA, CG.
6.
Нуклеотиду А, как в первом, так и во втором положении кодонов XYZ (AYZ, XAZ), соответствуют АК с двойными и
полуторными связями между атомами углерода, азота и кислорода в функциональных
окончаниях радикалов. Квадруплеты GA, AA, AG.
7.
Квадруплет GG, кодирующий Глицин, находится, как и остальные диагональные, в
особом положении. Квадруплеты UU, CC, AA, GG.
Перечисленные закономерности полностью подтверждают
идею В. Гусева о детерминированности Генетического кода. Эти 7 частных детерминант и составляют вариант
шестого правила.
Природа обнаруженных закономерностей
пока остаётся загадкой. Возможно, что порядок «идентифицирующих»
нуклеотидов определяет конфигурацию
функциональных групп кодонов, а это и обеспечивает срабатывание механизма «ключ
– замок».
Таблица 2.
"""
Ни что, вообще-то, не мешает допустить любой
вариант (механизм) посредничества. Так или иначе, кодон опосредованно воспримет
индивидуализм АК и, наоборот, АК опосредованно распознает кодон. Но это уже при
эволюционно сформировавшемся механизме воспроизведения. Допуская
кооперативность начальных процессов образования цепочек АК (прототипов белков)
и НК (нуклеиновых кислот), предположим, что именно эволюционирующие
белки диктовали свои условия построения нуклеотидной последовательности,
«записывали» в НК инструкции по сборке.
Это возможно, когда
АК способна сама себе сопоставить и «запомнить» кодон. Происходит, другими словами, эпизодическая запись белковой
информации на продолжающей расти НК-последовательности. Процесс может прерываться, и тогда образуются некодирующие
участки НК – интроны.
Рис.
15
Взаимодействие
АК-кодон в водном окружении может быть описано как взаимодействие масс
(молекулярных весов):
Mw(cd) =
- k*Mw(aa) +d* Mw(z) ------------ 2.
Mw(z) – молекулярный вес участка сахаро-фосфатной цепи,
принадлежащей кодону,
Mw(cd) – молекулярный вес кодона,
Mw(aa) -
молекулярный вес аминокислоты,
K »
2.64 – коэффициент взаимодействия,.
d – коэффициент пропорциональности.
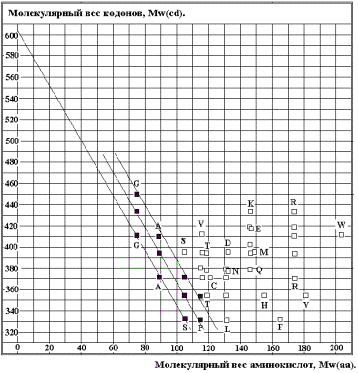
На рисунке 15 приведены теоретические
прямые для простейших (компактных) АК: Gly (G), Ala (A), Ser (S), Pro (P). Значение Mw(z) » 600,
k »
2,64.Чёрные прямоугольники – значения для этих АК из таблицы генетического
кода. Вырожденность генетического кода отражена семейством четырёх прямых
(нижняя состоит из двух). В
соответствии с формулой 2 Глицин (G) «выберет»
кодоны GGU и GGC. Так как
Глицин при «выборе» кодона по стерическим соображениям не нуждается в третьем
нуклеотиде (двухбуквенное кодирование), то он займёт весь квадруплет GG. Аналогичные рассуждения позволяют предсказать существующее
АК-кодонное соответствие для Аланина (A), Серина (S) и Пролина (P).
Для остальных АК, имеющих
сложные радикалы, естественно, возможны другие закономерности по следующим
причинам:. рассредоточение массы АК за счёт вынесенного в сторону от ядра
радикала, роль электростатических и, возможно, иных взаимодействий.
Совпадение с приведённой формулой
подтверждает гипотезу о проявлении кодон – АК соответствия на ранней стадии
молекулярной эволюции при непосредственном взаимодействии АК и нуклеотидов.
Система координат «Mw(aa) – Mw(cd)» позволяет увидеть сам принцип
соответствия для малых (компактных) аминокислот. Количественные соотношения
возможны лишь в целых числах. С этой целью преобразуем упомянутую систему в
систему «Число атомов C, N, O аминокислоты, n(aa) ---- число
атомов C, N, O кодона, n(cd)» по
формулам:
n(aa) = |Mw(aa)/13.75| и n(cd) = |Mw(cd)/13.75| 3
(В
правых частях формул произведено округление к ближайшему целому числу).
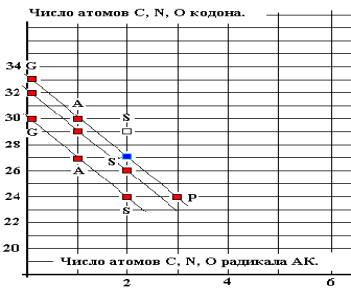
Рис. 16.
На графике выделены линейные
зависимости n(cd) = k*n(aa) + B(i) для GAS, GASP, соответствующие тем же группам АК
в схеме классификации АК по молекулярным массам. Линейная корреляция (Рис. 16)
описывается формулой:
N(cd) = - 3* n(aa) +
B(i) -------------- для GAS, GASP, 4
Это преобразованная по
соотношениям 3 формула 2 ( коэффициент к @
2,64 округлено до ближайшего целого числа 3).
КОДИРОВАНИЕ ПРОСТЕЙШИХ
АМИНОКИСЛОТ ОПРЕДЕЛЯЕТСЯ СООТНОШЕНИЕМ МОЛЕКУЛЯРНЫХ МАСС АК И КОДОНОв, что
соответствует совремённой версии ГК и позволяет использовать эти данные, как
опорные.
------------------------------------------------------------------------------------------------------------------------------------------------------
"""
Есть ещё одно удивительное соответствие –
молекулярных весов АК и аминоацил-т-РНК-синтетаз (АРС-аз). Особенно интересны данные, приведённые на графике 28.
По данным ААRSDB Польской АН (http://biobases.ibch.poznan.pl/aars/seq_main.html)
построены графики - СПЕКТРЫ ВСТРЕЧАЕМОСТИ. По осям отложены молекулярные веса
аминокислот и АРС-аз. На приведённых рисунках 17, 18 и 20 видна общность
корреляций для архей и эукариот. У бактерий ( рис. 19) соответствие совершенно
другое! Не свидетельство ли это эволюционного расхождения ветвей бактерий и
архей?
Чёрными кружками на графиках обозначены
аминокислоты (V, I, L, T, K, M, F, W), не
синтезируемые в организмах. Серыми – синтезируемые в незначительных количествах
(R, H). Напрашивается вывод о том, что для
АК, синтезируемых в организмах («рибосомных АК») действует специальная группа
АРС-аз, с меньшим молекулярным весом (Рис. 23).
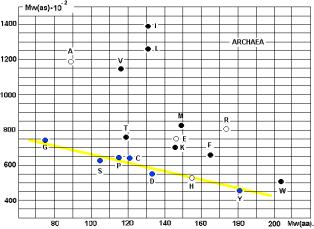
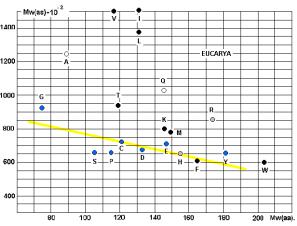
Рис. 17.
Рис. 18.
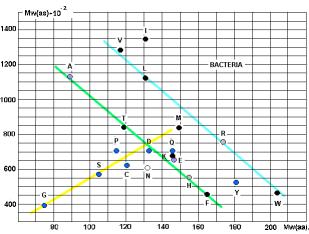
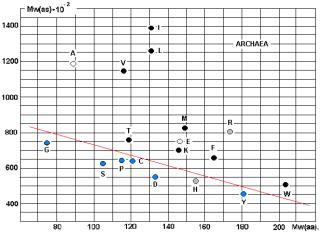
Рис.19.
Рис. 20.
Линия, разделяющая АК, не
синтезируемые в организмах, от «родных», показана на Рис. 20. Исключения: A, E.
"""
СПЕКТРЫ ВСТРЕЧАЕМОСТИ АМИНОКИСЛОТ В БЕЛКАХ.
Рис. 21
Установленное
выше соотношение между молекулярными весами АК и молекулярными весами
соответствующих им кодонов находит дополнительное подтверждение в распределении
АК в белках. В первом разделе предложена идея
о встраивании АК в цепочки протонизированных капель пропорционально
молекулярным весам. Вероятнее всего,
ближе к центру капли (в начале цепочек) располагались наиболее лёгкие молекулы
– G,A, а сама последовательность
простейших АК могла сохраниться в древних белках, как реликтовая. В частной
переписке В. А. Гусев предположил, что если идея верна, то этот реликт, скорее всего, обнаружится в рибосомных
белках, а в белках позднего происхождения «размоется» в процессе эволюции.
С целью подтверждения этих гипотез были
исследованы встречаемости АК в различных
семействах белков прокариот и эукариот – всего 160 белков из Swiss Prot:
75 белков S8, S8e, S8p, S12-S15 рибосомных субъединиц 30S и 40S.
53 белка – полимераз аппарата транскрипции.
5 белков – регуляторов
транскрипции.
27 белков с различными
каталитическими функциями
По выборкам из Архей, Бактерий,
Протеобактерий и некоторых эукариот
строились спектры встречаемости
АК в зависимости от молекулярного веса (Рисунки 21 – 26). Особенно
подробно рассмотрены рибосомные белки S8 – ответственные за формирование центрального домена р-РНК.
Белки этого семейства наиболее древние потомки белков из организмов
рассматриваемых надцарств, и именно они могут содержать реликтовую
последовательность: Met(M) --- V, T, P, S, A, G, вероятно, в произвольном сочетании простейших
АК. Ожидается так же отражение линейной зависимости молекулярных весов АК и
кодонов в спектрах встречаемости АК в белках.
Действительно, подсчёт числа тетра- и трипептидов, включая стартовый M (в выровненных
последовательностях), в 150-и белках
привёл к следующим результатам по встречаемости (М-АК-остатки):
Археи, белки S8
---------------------------трипептид --- 77%,
Бактерии, белки S8
----------------------трипептид --- 60%.
Среднее для
тетрапептидов ---------- 36%.
Археи, белки S8e
------------------------- 55%,
Археи, аппарат транскрипции ------ 40%.
Среднее для
тетрапептидов ---------- 18%.
Этими данными подтверждается эволюционное
размытие последовательности (M – V, T, P, S, A, G) простейших АК.
Что касается отражения линейной зависимости
молекулярных весов (Мв) аминокислот и кодонов в спектрах встречаемости, то анализ
ниже приведённых спектров позволяет сделать следующие выводы:
1.
У белков
семейства S8 малой субъединицы 30S, наиболее
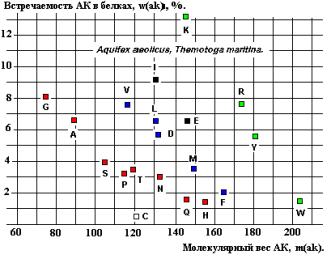
древних представителей Бактерий Aquifex aeolicus и Thermotoga maritime, спектры
содержат линейную зависимость встречаемости от Мв для последовательностей G-A-S-P и T-N-Q-H
(возможно, V, L, D, M, F и K, R, Y, W - Рисунки 22 и 24), соответствующую
установленной закономерности (см. формулу 2).
2.
В тех же
более «молодых» белках S8 наблюдается эволюционное размытие реликтовых корреляций, как это видно на примере Pyrobaculum aerophilum из Архей
(Рис.25).
3.
Аналогичное
размытие в спектре встречаемости белков аппарата транскрипции (Рис. 27 –
среднее из 8 организмов Архей). Это может свидетельствовать об эволюции функций
белка, либо о синтезе новых белков с новыми функциями.
4.
По спектру
прионов ( последовательность АК из работы(3)) можно сделать неожиданный вывод о
почти случайном и почти одинаковом
распределении встречаемости АК в этих белках (Рис.26). Аналогичное, но
вполне ожидаемое, случайное распределение отмечено и для некодирующих интронов
на примере E.Coli (4).
5.
Реликтовая
последовательность GAS отмечена и в
спектрах встречаемости АК в РСА-зах (Показано на примере Glycil-tRNA-syntetase на рисунках 23 и 28).
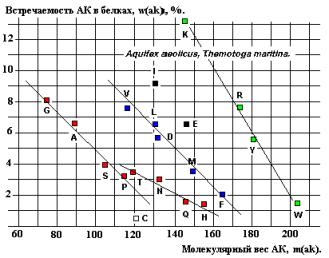

Рис. 22.
Рис. 23.
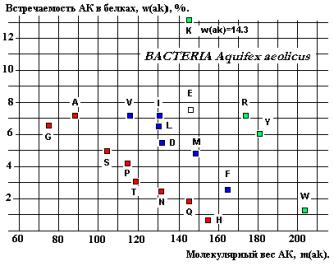
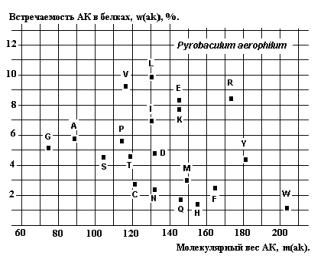
Рис. 24. Рис. 25.
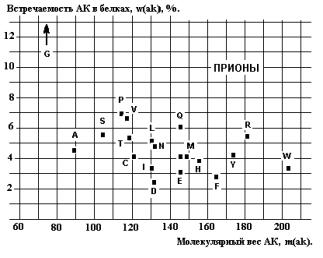
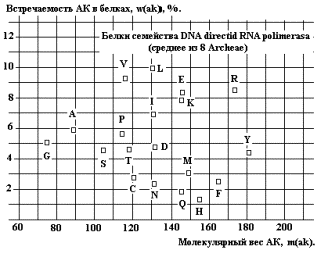
Рис. 26.
Рис. 27.
На графике (Рис. 28) сравниваются спектры
встречаемости G, A, S, P, C двух
микроорганизмов – Aquifex aeolicus и Themotoga maritina
со спектром Glycil-tRNA-syntetasa микроорганизма Aeropyrum pernix.
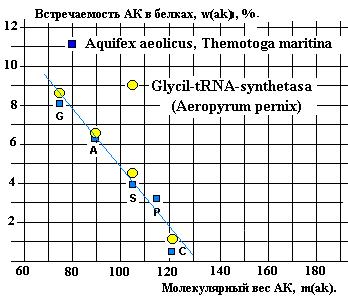
Рис.28.
И ещё один интересный факт,
ожидающий объяснения.
В белках семейства S8 древнейших
микроорганизмов сумма встречаемостей (в %) аминокислот, синтезируемых в
организмах приблизительно такая же, как и сумма встречаемостей АК, в списке (в списке однородная
встречаемость, равная 5% для каждой АК). Действительно: для микроорганизмов Aquifex aeolicus и ряда других из Архей и ранних бактерий сумма
встречаемостей (среднее из 12 микроорганизмов) åv(G,A,S,P,C,N,D,Q.E,H,R,Y) @ 55%,
Для этой же суммы из списка АК åv = 60%.
В случае a- и g-протеобактерий среднее значение åv cовпвдает с значением 60% из списка АК.
"""
Оценить степень эволюционного размытия корреляции (например G, A, S, P, T, N, Q, H) можно сопоставлением коэффициента
размытия с временем происхождения микроорганизма. Определив этот коэффициент
как среднюю (по 8-и АК) сумму расстояний точек, соответствующих координатам АК,
на графике от корреляционной прямой GAS (Рис. 22). Результат представлен графически (Рис. 29).
Здесь и везде исползована основанная на
палеонтологических данных «молекулярная шкала» из работы Battistuzzi F.U., Feijao A., Hedges S.B. A (2), цитируемой А. Марковым (5).
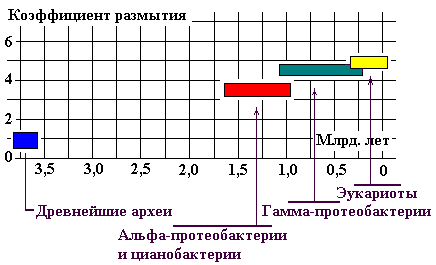
Рис. 29.
"""
Выводы и правила отбора.
Логичнее говорить о совершенствовании способа реализации генетического кода,
но не о его формировании. Код проявился автоматически для четырёхбуквенной
символьной последовательности и отобранного в процессе эволюции белков набора
20 протеиногенных аминокислот. Свойства этого набора и свойства символьной
последовательности регламентировали предельно возможное число аминокислот
значением 20 – 22 и определили кодон - аминокислотное соответствие.
В последующем прямое
распознавание кодонов аминокислотами становится невозможным (разрушается
сопряженность в кооперативном взаимодействии АК – азотистые основания – сахара
– полифосфатные цепи) - эстафета передаётся нуклеиновым кислотам. Формируется
новый молекулярный мир с уже сложившимся соответствием между АК и матричными
макромолекулами (РНК) – носителями генетического материала, синтезируются
посредники и «устройства» для синтеза. (Ниже это будет продемонстрировано на
примере белков про- и эукариот). Предложенная схема, мне кажется, устраняет
проблему безматричного синтеза в белково-коацерватной теории Опарина - Холдейна.
Процесс молекулярной эволюции описывается последовательностью формул:
АК D
Белок, Белок D
РНК, РНК D
ДНК ® Белок, ДНК D
РНК "
Белок.
Нет необходимости
пересматривать Центральную догму ДНК D
РНК ® Белок. В процесс эволюции
вовлечены не только материальные объекты, но и процессы. Так на начальном этапе
молекулярной эволюции с переходом от молекул к их полимерам действовала
формула Белок ®
РНК D
ДНК. Изменился (эволюционировал)
процесс, изменилась и форма его записи. Приведённые данные и их анализ
позволяет признать первичность белков в эволюционном процессе возникновения
Жизни.
ПЕРВОЕ ПРАВИЛО
ОТБОРА:
При
триплетном кодировании четырёхбуквенной
символьной последовательностью таблица «выделяет» из множества максимум 24
объекта и сортирует их по размерам с различной вырожденностью кода в отношении
один к двум (m/n = ½).
ВТОРОЕ
ПРАВИЛО ОТБОРА:
Подчиняясь единому универсальному алгоритму кодирования ( старт ’ запись ’ стоп ’ старт ’ чтение ’ стоп ),
четырёхбуквенная последовательность азотистых оснований кодирует 20
протеиногенных аминокислот и распределяет их по квадруплетам с высокой и низкой
энергией.
Квадруплетами с
низкой внутренней энергией кодируются 8 «компактных» АК с радикалом,
расположенным над ядром молекулы.
Третье правило отбора:
(Двубуквенное кодирование)
Положение аминокислоты в квадруплете
определяется количеством СН2-групп в аминокислотном остатке (радикале), то есть
длиной цепочки, соединяющей функциональную часть радикала с основанием молекулы
(ядром). Аминокислоты C,J,N,D,H,F,Y кодируются
верхними парами кодонов типа XYU, XYC; аминокислоты Q,K,E,M,W – нижними, типа XYA, XYG. Третий нуклеотид
пары кодонов (C, U и A, G) для АК каждой группы
определяет положение АК в квадруплете. Кодирование, таким образом,
ДВУХБУКВЕННОЕ. Как следствие: легко показать, что предельно возможное число
кодируемых объектов 24.
Аминокислота не
различает U или С, А или G в третьей позиции кодона. Отличает лишь их пары, имеющие различный размер.
Кодоны AUA, AUG и UGA, UGG являются исключением из того правила – кодирование Изолейцина (AUA) и редкое кодирование Селеноцистеина (UGA). Возможно это более поздние эволюционные
корректировки Природы.
ЧЕТВЁРТОЕ ПРАВИЛО ОТБОРА.
(о вырожденности «6»)
Молекулы Серина (S), Лейцина (L) и Аргинина (R) принадлежат к группе АК с вырожденностью кода 4, но имеют
цепочки из СН2-групп.Так как Серин содержит одну СН2-группу, то он может
дополнительно кодироваться верхней парой кодонов. Аргинин содержит три
СН2-группы и дополнительно может кодироваться нижней парой кодонов. Лейцин, в
дополнение к СН2-группе, имеет в
цепочке ещё и группу СН и, поэтому, кодируется ещё и нижней парой кодонов.
ПЯТОЕ ПРАВИЛО ОТБОРА.
(эвристическое)
Кодон-аминокислотное
соответствие для аминокислот этих групп может быть установлено по эвристическим
правилам…
ШЕСТОЕ ПРАВИЛО ОТБОРА.
1.
Нуклеотиду U во втором
положении кодонов XUZ (первый столбец квадруплетов)
соответствуют АК с двумя группами СН3 у функциональной части радикала, Метионин (M) (-S—CH3) и Фенилаланин (F). Квадруплеты UU, CU, AU, GU.
2.
Этому же нуклеотиду
U в
первом положении кодонов UYZ (первая строка
квадруплетов) соответствуют АК с группами –OH, -SH и АК с циклами, сдержащими систему
сопряженных связей ( Фенилаланин, Тирозин, Триптофан, и квазицикл Серина ). Квадруплеты UU, UC, UA, UG.
3.
Кодоны квадруплета UU,
находящегося на пересечении первых столбца и строки таблицы, соответствуют
АК-м, отвечающим условиям строки и столбца – Фенилаланину и Лейцину.
4.
Нуклеотиду С во втором положении кодонов XCZ ( часть второго столбца квадруплетов после Пролина)
соответствуют АК с группами –ОН , -СН3
и «копромисная» молекула Пролин. У конформера Треонина –ОН группа блокирована
водородной связью; активна, следовательно, группа СН3. Он, как и Аланин
расположен во втором столбце таблицы. Квадруплеты CC, AC, GC.
5. Нуклеотиду С
в первом положении кодонов CYZ (часть второй строки
квадруплетов после Пролина) соответствуют АК со связями –C=C-,
-C=N-. «Копромисный» Пролин - нечто среднее между алифатическими АК и
аминокислотами, содержащими двойные и полуторные связи между углеродом и
азотом. Расположена эта молекула, соответственно, на пересечении второго
столбца и второй строки в квадруплете СС.
Квадруплеты CC, CA, CG.
6.
Нуклеотиду А, как в первом, так и во втором положении кодонов XYZ (AYZ, XAZ), соответствуют АК с двойными и полуторными связями между атомами
углерода, азота и кислорода в функциональных окончаниях радикалов. Квадруплеты GA, AA, AG.
7.
Квадруплет GG, кодирующий Глицин, находится, как и
остальные диагональные, в особом
положении. Квадруплеты UU, CC, AA, GG.
"""
![]()
Автор признателен
доктору В.А. Гусеву (Институт математики им. Соболева СО РАН, г. Новосибирск)
за интерес к работе, полезные рекомендации и замечания.
Благодарю
проф. А.В. Маркова за размещение ссылок на мои электронные публикации
на сайте http://macroevolution.narod.ru/
"""
P.S.
Приведу цитату из работы по компьютерному
моделированию процесса в опаринском бульоне.
http://www.biomedcentral.com/1471-2148/3/12
Армен Мулкиджанян, биофизик из немецкого Университета
Оснабрюкска, и его коллеги Михаил Гальперин из Национального института здоровья США и Дима Черепанов показали в своей работе, что
жесткое ультрафиолетовое излучение не препятствовало зарождению жизни на берегу
океана.
« As condensation of sugar phosphates
and nitrogenous bases is thermodynamically unfavorable, these compounds, if
ever formed, should have undergone rapid hydrolysis. Thus, formation of
oligonucleotide-like structures could have happened only if and when these
structures had some selective advantage over simpler compounds. It is well
known that nitrogenous bases are powerful quenchers of UV quanta and
effectively protect the pentose-phosphate backbones of RNA and DNA from UV
cleavage. To check if such a protection could play a role in abiogenic
evolution on the primordial Earth (in the absence of the UV-protecting ozone
layer), we simulated, by using Monte Carlo approach, the formation of the first
oligonucleotides under continuous UV illumination. The simulations confirmed
that UV irradiation could have worked as a selective factor leading to a
relative enrichment of the system in longer sugar-phosphate polymers carrying
nitrogenous bases as UV-protectors. Partial funneling of the UV energy into the
condensation reactions could provide a further boost for the oligomerization ».
"""
Отсутствие значения вырожденности «5» в
совремённой версии можно объяснить.
Число объектов (АК и знаков терминации) с вырожденностью «1» два, с вырожденностью «2» девять, с вырожденностью «3» два, с вырожденностью «4» пять – всего они занимают 46 позиций
(кодонов) из 64-х. Обозначим через n(i) – числа
объектов с соответствующими вырожденностями.
Так как сумма произведений числа объектов на соответствующие им значения
вырожденностей равна числу позиций ГК, то
n(1) + 2n(2) + 3n(3) + 4n(4) + 5n(5) + 6n(6) = 64, но n(1) + 2n(2) + 3n(3) + 4n(4) = 46,
тогда: 5n(5) = 18 – 6n(6).
При n(6) = 1 n(5) = 12/5 ----
лишено смысла,
при n(6) = 2 n(5) = 6/5 ---- лишено смысла,
при действующем значении n(6) =
3 n(5) = 0
Таким образом, при сложившейся версии ГК вырожденности «5» быть не может.
"""
Полезно вспомнить:
«Общеизвестно, например, определение
Энгельса: «Жизнь есть способ существования
белковых тел, и этот способ существования состоит по своему существу в
постоянном самообновлении химических составных частей этих тел» (Маркс
К. и Энгельс Ф., Соч., 2 изд., т. 20, с. 82).
А.А.Ляпунов: Жизнь - «высокоустойчивое
состояние вещества, использующее для выработки сохраняющих реакций информацию,
кодируемую состояниями отдельных молекул».
(См. доклад А. А. Ляпунова «Об управляющих системах
живой природы и общем понимании жизненных процессов» — М., 1962.)»
"""
ЛИТЕРАТУРА.
1. В.А.
Гусев, Доклады РАН, v. 385, №3, 2002
В.А. Гусев, Биофизика, т. 46, вып. 5,
2001
2. Battistuzzi F.U., Feijao A., Hedges S.B. A genomic timescale of prokaryote evolution: insights
into the origin of methanogenesis,
phototrophy, and the colonization of land // BMC Evol Biol.
2004; 4: 44.
http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=533871
3. ПРИОН:
http://nanoworld2003.narod.ru/01/DATA/TEXTS.RUS/19990822/5.htm
4.
ИНТРОН: http://www.cyber-dyne.com/~tom/5prime_3prime.html#Leader
http://www.nature.ru/db/author.html?id=10548
5.
А. В. Марков http:/macroevolution.narod.ru
6.
А.В. Финкельштейн и О.Б. Птицин «Физика белка» (http://kdu2001.narod.ru/g_belok.html).
Анимация из сайта «textronica»
"""
![]()
© Copyright Керимбеков А.В. 6 апреля 2004 г. Ссылки обязательны.
Последнее обновление: 14 октября 2007 г.
